Para que tu visita sea de provecho y realmente te sirva, te recomiendo hacer uso de las pestañas
- Introducción
- Alcanos Usos y Aplicaciones
- Fórmula y Nomenclatura
- Impacto Ambiental.
Un espacio para aprender, compartir y crecer en el apasionante estudio de la Química.
Para que tu visita sea de provecho y realmente te sirva, te recomiendo hacer uso de las pestañas
Los invito a conocer qué son estos compuestos, y en especial estudiar a los alcanos, alquenos y alquinos.
Les comparto unos videos para conocer estos hidrocarburos de cadena abierta.
Para esta Introducción, ahora prestamos atención a los ALCANOS:
Esta Información profundiza sobre los usos de los ALCANOS
Te invito a diseñar tus alcanos:
Para aprender a escribir escribir la fórmula y nombrar a los alcanos, los invito a mirar el siguiente video explicativo:
RESUMIENDO:
Los alcanos se pueden nombrar siguiendo siete etapas:
Regla 1.- Determinar el número de carbonos de la cadena más larga, llamada cadena principal del alcano. Obsérvese en las figuras que no siempre es la cadena horizontal.
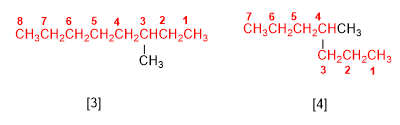
[3 ] 3-metiloctano
[4 ] 4-metilheptano
El nombre del alcano se termina en el nombre de la cadena principal (octano, heptano) y va precedido por los sustituyentes.
Regla 2.- Los sustituyentes se nombran cambiando la terminación –ano del alcano del cual derivan por –ilo (metilo, etilo, propilo, butilo). En el nombre del alcano, los sustituyentes preceden al nombre de la cadena principal, y se acompañan de un localizador que indica su posición dentro de la cadena principal. La numeración de la cadena principal se realiza de modo que al sustituyente se le asigne el localizador más bajo posible.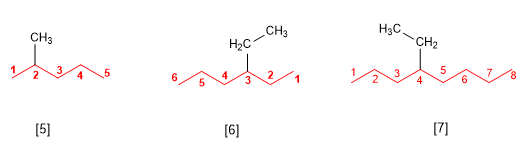
[5 ] 2-Metilpentano
[6 ] 3-Etilhexano
[7 ] 4-Etiloctano
Regla 3.- Si tenemos varios sustituyentes se ordenan alfabéticamente precedidos por lo localizadores. La numeración de la cadena principal se realiza para que los sustituyentes en conjunto tomen los menores localizadores.
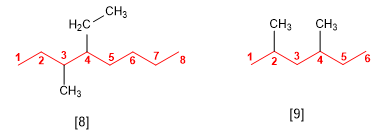
[8 ] 4-Etil-3-metiloctano
[9 ] 2,4-Dimetilhexano
Si varios sustituyentes son iguales, se emplean los prefijos di, tri, tetra, penta, hexa, para indicar el número de veces que aparece cada sustituyente en la molécula. Los localizadores se separan por comas y debe haber tantos como sustituyentes.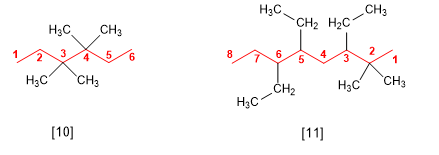
[10 ] 3,3,4,4-Tetrametilhexano
[11 ] 3,5,6-Trietil-2,2-dimetiloctano
Los prefijos de cantidad no se tienen en cuenta al ordenar alfabéticamente.
Regla 4.- Si al numerar la cadena principal por ambos extremos, nos encontramos a la misma distancia con los primeros sustituyentes, nos fijamos en los demás sustituyentes y numeramos para que tomen los menores localizadores.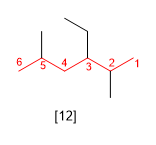
[12 ] 3-Etil-2,5-dimetilhexano
Regla 5.- Si al numerar en ambas direcciones se obtienen los mismos localizadores, se asigna el localizador más bajo al sustituyente que va primero en el orden alfabético.
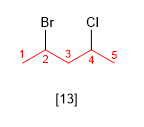
[13 ] 2-Bromo-4-cloropentano
Regla 6.- Si dos a más cadenas tienen igual longitud, se toma como principal la que tiene mayor número de sustituyentes.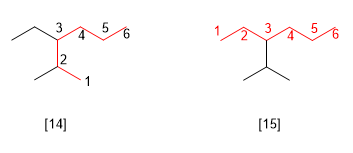
[14 ] 3-Etil-2-metilhexano (correcto)
[15 ] 3-Isopropilhexano (incorrecto)
Regla 7.- Existen algunos sustituyentes con nombres comunes aceptados por la IUPAC, aunque se recomienda el uso de la nomenclatura sistemática.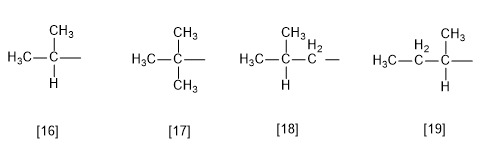
[16 ] Isobutilo (1-metiletilo)
[17 ] tert-butilo (1,1-dimetiletilo)
[18 ] Isobutilo (2-metilpropilo)
[19 ] sec-butilo (1-metilpropilo)
Los nombres sistemáticos de estos sustituyentes se obtienen numerando la cadena comenzando por el carbono que se une a la principal. El nombre del sustituyente se forma con el nombre de la cadena más larga terminada en –ilo, anteponiendo los nombres de los sustituyentes que tenga dicha cadena secundaria ordenados alfabéticamente. Veamos un ejemplo:
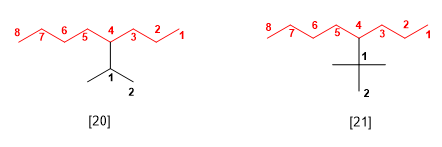
[20 ] 4-Isopropiloctano (4-(1-metiletil)octano)
[21 ] 4-tert-butiloctano (4-(1,1-dimetiletil)octano)
a. 2,4,6-trimetiloctano
b. 2,2,3-trimetilpropano
c. 3,6,7-tiertil-2,2,8,8-tetrametil-5-propildecano
d. 4,4-dietil-2,5,6-trimetilheptano
e. 3,4-dietil-3,4-dimetilhexano
f. 3,5-dietil-4,7-dimetil-6-propilnonano
Utilizando los sitios que aprendimos a utilizar para formular compuestos
El proceso de la combustión
La combustión es un proceso general de todas las moléculas orgánicas, en la cual los átomos de carbono de la molécula se combinan con el oxígeno convirtiéndose en moléculas de dióxido de carbono (CO2) y los átomos de hidrógeno en agua líquida (H2O). La combustión es una reacción exotérmica, el calor desprendido se llama calor de combustión y en muchos casos puede determinarse con exactitud, lo que permite conocer el contenido energético de las moléculas.
Reacción de combustión balanceada:
![]()
Nos acercamos a la meta...
Recordamos la consigna con la que inició y ahora termina el proyecto:
A partir de la investigación que cada equipo fue realizando, se generó un informe que debe ser presentado de modo impreso en la fecha que se indique en clase.
También les pido elaborar una presentación, que puede ser realizada en prezi, canva, presentación de google, etc.
La finalidad de la presentación será resumir lo más relevante de la investigación para darla a conocer al resto de los equipos y al colegios en general.
Para realizar un trabajo significativo, es IMPORTANTE, equilibrar en la presentación la información escrita, con imágenes, videos, incluso música, para que dicho trabajo sea dinámico y atractivos para quien acceda a la presentación.
La misma debe contar con los nombres y apellidos de los autores, y se debe compartir con un enlace que dirija a la presentación, realizando un comentario a esta entrada.
Por último te pido que completes esta breve encuesta para conocer tu opinión sobre este blog: